科研进展
北京生命科学研究所叶克穷实验室在《自然》杂志上发表文章(Article)“Crystal structure of an H/ACA box ribonucleoprotein particle”(2006年8月30日在线,Advance online publication)。
北京生命科学研究所叶克穷实验室在《自然》杂志上发表文章(Article)“Crystal structure of an H/ACA box ribonucleoprotein particle”(
假尿嘧啶是最普遍的RNA修饰形式。假尿嘧啶也被称为鸟嘌呤、腺嘌呤、胞嘧啶和尿嘧啶以外的第五种碱基。核糖体RNA就含有大量的假尿嘧啶,这些保守的假尿嘧啶位于核糖体关键功能区,一直被认为和核糖体的结构和功能有重要关系。H/ACA 复合物是一类从古细菌到人类高度保守的假尿嘧啶合成酶,主要催化核糖体RNA特定位点上的尿嘧啶转化为假尿嘧啶。H/ACA复合物也是目前发现最复杂的假尿嘧啶合成酶,由四个蛋白质Cbf5/dyskerin, Nop10, Gar1和L7ae,还有一条决定修饰特异性的H/ACA 向导RNA组成。该酶独特之处在于向导RNA的功能:向导RNA通过和底物RNA被催化的尿嘧啶两边的碱基序列互补配对来选择特定的修饰位点。这种由RNA介导的底物识别机理赋予了该酶“可编程”的能力,当复合物和不同的向导RNA结合后,就可以识别不同的底物位点。有近百种人源H/ACA RNA指导着假尿嘧啶的生物合成。另外,某些H/ACA 复合物还参与核糖体RNA的剪切加工,参与人类端粒酶的组成。基因分析已经证明该复合物中的dyskerin蛋白质突变可以引起一种罕见的“先天性角化不良”(dyskeratosis congenita) 遗传病。
该论文作者李玲和
该论文的第一作者
这篇文章的工作是受科技部863项目和北京市政府资助在北京生命科学研究所完成的。晶体衍射数据的采集获得了日本SPring-8同步辐射光源的支持。该工作还得到段景绮、康彦勇和王伟同学的帮助。
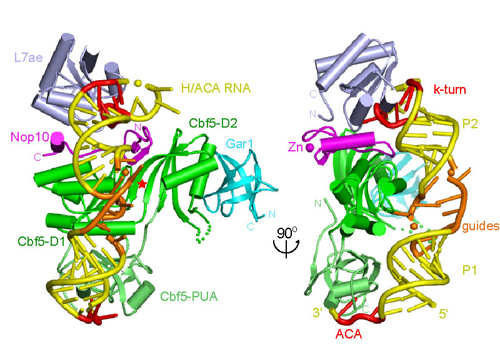
Crystal structure of H/ACA RNP.

作者左叶克穷博士,右李玲博士



